Σχεδιασμός Μελέτης
Η μελέτη TRIMAXIMIZE παρακολουθεί ασθενείς με μη ελεγχόμενο άσθμα που έλαβαν Trimbow® σε συνθήκες καθημερινής κλινικής πρακτικής για 1-3 έτη.
Trimbow® pMDl BDP/FF/G 87/5/9 ή 172/5/9 Δύο εισπνοές, Δις ημερησίως
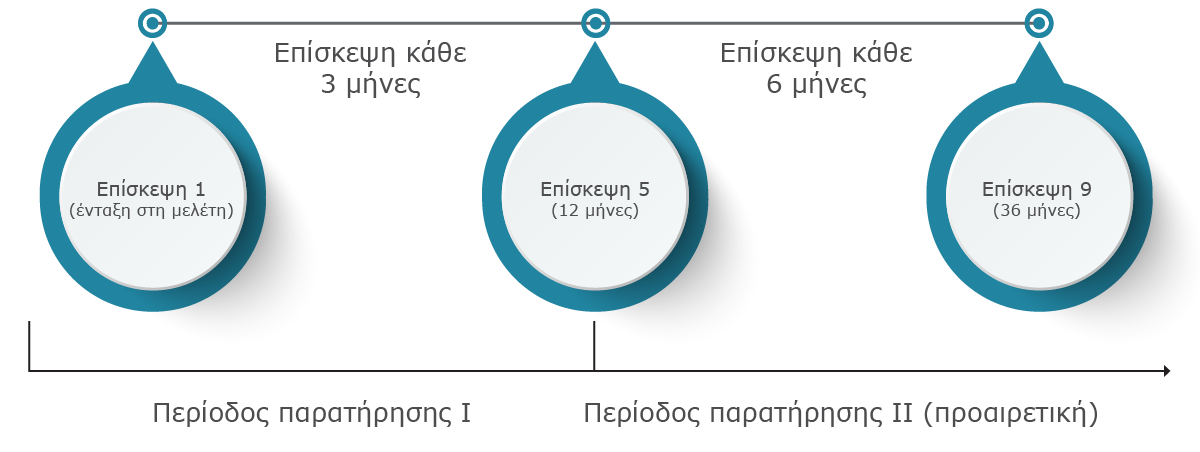
Προηγούμενη θεραπεία: ICS/LABA, ICS/LABA/LAMA (κλειστό ή ανοιχτό σχήμα)
Προσαρμογή από: Gessner C., et al., Am J Respir Crit Care Med 2023;207:A6649.
Πρωτεύον καταληκτικό σημείο
Μέθοδοι
- Πολυεθνική, πολυκεντρική, μη-παρεμβατική μελέτη παρατήρησης
- 125 κέντρα σε έξι χώρες (DE, UK, AT, DK, FR και ES)
- Aσθενείς με επιβεβαιωμένη διάγνωση άσθματος με ή χωρίς συνυπάρχουσα ΧΑΠ
- Αποτελέσματα από την ενδιάμεση ανάλυση μετά από έξι μήνες παρατήρησης
Πληθυσμός
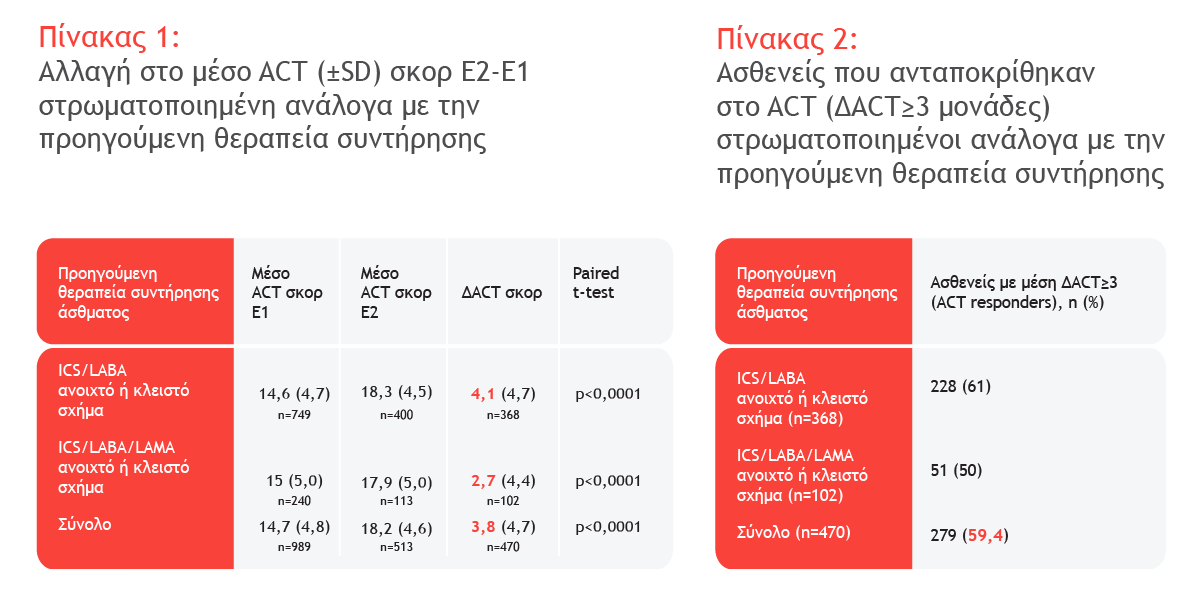
Αποτελέσματα ενδιάμεσης ανάλυσης 6 μηνών
|
||
|---|---|---|
| Ηλικία, έτη – μέση τιμή (±SD) |
|
58 (15) |
| Φύλο, n (%) | Γυναίκα
Άντρας |
690 (63,3)
400 (36,7) |
| BMI (Kg/m2), μέση τιμή (±SD) |
|
29,3 (7,8) |
| Ιστορικό καπνίσματος, n (%) | Πρώην καπνιστής
Ενεργός καπνιστής |
340 (31,2)
202 (18,5) |
| Πακέτο/έτη, μέση τιμή (±SD) | Πρώην καπνιστής
Ενεργός καπνιστής |
19,1 (15,5)
24,9 (15,5) |
| Χρόνος από τη διακοπή καπνίσματος, έτη (±SD) |
|
14,8 (12,5) |
| Χρόνος από τη διάγνωση έως την πρώτη επίσκεψη, έτη (±SD) |
|
14,4 (14,1) |
| FEV1 % επί της προβλεπόμενης τιμής στην έναρξη της μελέτης, μέση τιμή (±SD) |
|
67,08(16,96) |
| Ρυθμός παροξύνσεων το προηγούμενο έτος, μέση τιμή (±SD) |
|
1,8 (1,7) |
| Θεραπεία συντήρησης για το άσθμα πριν την αλλαγή σε Trimbow, n% | ICS/LABA (σταθερός)
ICS/LABA (ανοιχτός)
ICS/LABA/LAMA (σταθερός)
ICS/LABA/LAMA (ανοιχτός) |
787 (72,2)
34 (3,1)
17 (1,6)
252 (23,1) |
| Κατηγοριοποίηση σύμφωνα με τα κριτήρια GINA, n(%) | GINA Βήμα 4
GINA Βήμα 5 |
878 (82,6)
185 (17,4) |
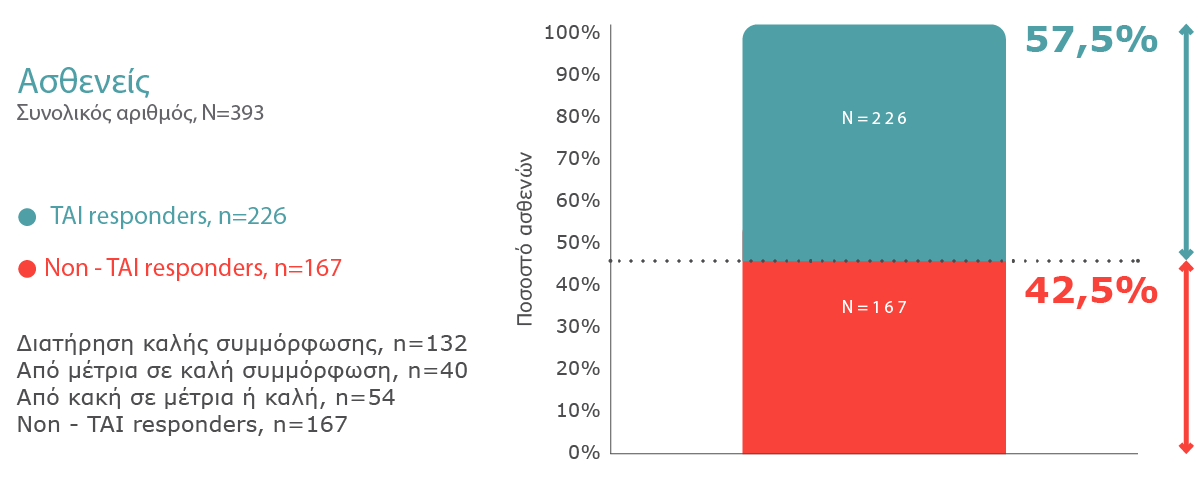
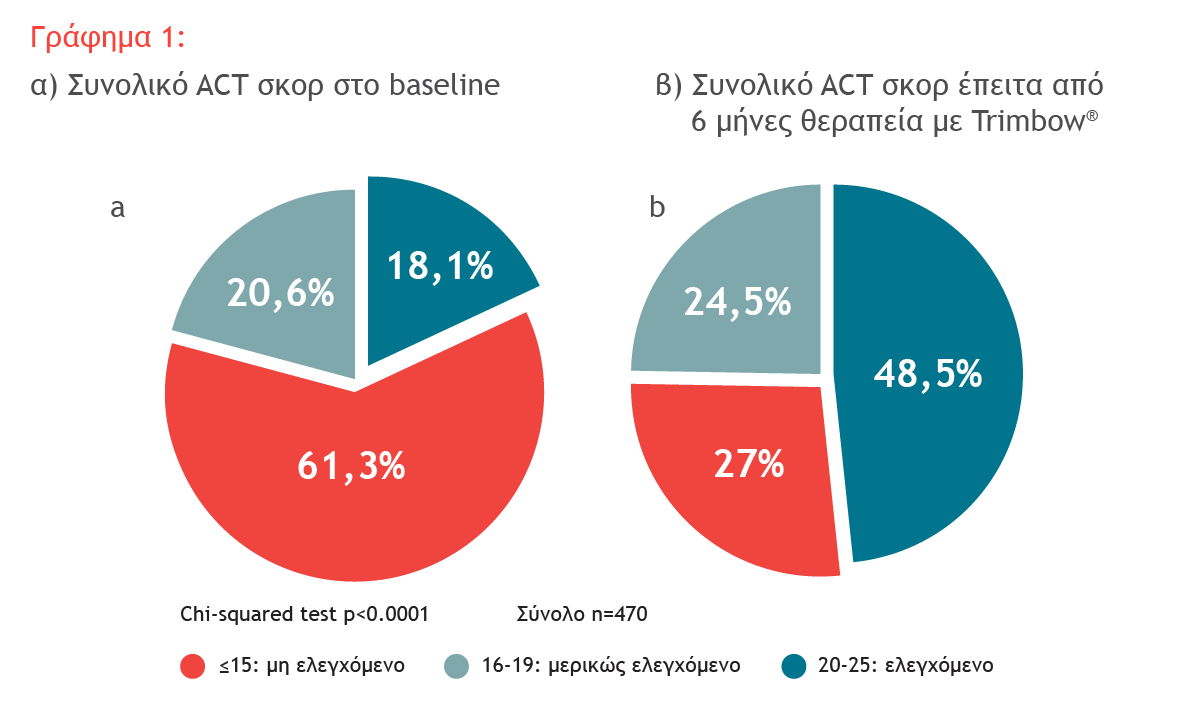
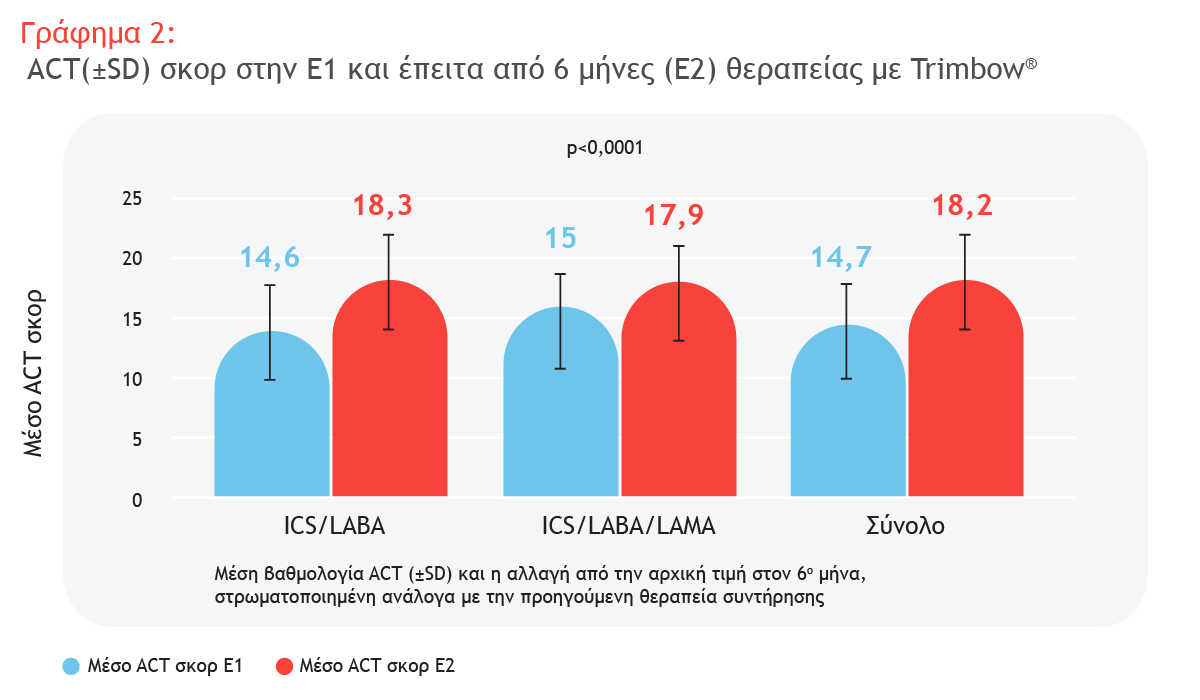
Αποτελέσματα Μελέτης
Ενδιάμεση ανάλυση 6 μηνών

Περίληψη Προφίλ Ασφάλειας Trimbow® 87/5/9:2
Οι πιο συχνά αναφερθείσες ανεπιθύμητες ενέργειες σε ασθενείς με ΧΑΠ ή άσθμα είναι αντίστοιχα: δυσφωνία (0,3% και 1,5%) και στοματική καντιντίαση (0,8% και 0,3%), οι οποίες συσχετίζονται κατά κανόνα με τα εισπνεόμενα κορτικοστεροειδή, μυϊκοί σπασμοί (0,4% και 0,2%), οι οποίοι μπορούν να αποδοθούν στο συστατικό β2 διεγέρτη μακράς δράσης και ξηροστομία (0,4% και 0,5%), η οποία αποτελεί τυπική αντιχολινεργική δράση. Σε ασθματικούς ασθενείς, οι ανεπιθύμητες ενέργειες τείνουν να συγκεντρώνονται κατά τη διάρκεια των πρώτων 3 μηνών μετά την έναρξη της θεραπείας και γίνονται λιγότερο συχνές με τη μακροχρόνια χρήση (μετά από 6 μήνες θεραπείας). Το Trimbow® αντενδείκνυται σε ιστορικό υπερευαισθησίας στις δραστικές ουσίες ή σε κάποιο από τα έκδοχά του. Για περισσότερες πληροφορίες για τις ανεπιθύμητες ενέργειες του Trimbow® συμβουλευτείτε την Περίληψη Χαρακτηριστικών Προϊόντος του Φαρμάκου.2
Περίληψη Προφίλ Ασφάλειας Trimbow® 172/5/9:3
Οι πιο συχνά αναφερθείσες ανεπιθύμητες ενέργειες σε ασθενείς με ΧΑΠ ή άσθμα είναι αντίστοιχα: δυσφωνία (0,3% και 1,5%) και στοματική καντιντίαση (0,8% και 0,3%), οι οποίες συσχετίζονται κατά κανόνα με τα εισπνεόμενα κορτικοστεροειδή, μυϊκοί σπασμοί (0,4% και 0,2%), οι οποίοι μπορούν να αποδοθούν στο συστατικό β2 διεγέρτη μακράς δράσης και ξηροστομία (0,4% και 0,5%), η οποία αποτελεί τυπική αντιχολινεργική δράση. Σε ασθματικούς ασθενείς, οι ανεπιθύμητες ενέργειες τείνουν να συγκεντρώνονται κατά τη διάρκεια των πρώτων 3 μηνών μετά την έναρξη της θεραπείας και γίνονται λιγότερο συχνές με τη μακροχρόνια χρήση (μετά από 6 μήνες θεραπείας). Το Trimbow® αντενδείκνυται σε ιστορικό υπερευαισθησίας στις δραστικές ουσίες ή σε κάποιο από τα έκδοχά του. Για περισσότερες πληροφορίες για τις ανεπιθύμητες ενέργειες του Trimbow® συμβουλευτείτε την Περίληψη Χαρακτηριστικών Προϊόντος του Φαρμάκου.3
Βιβλιογραφία
1. Greulich T. et al., ERS 2024 poster ID 3907
2. Περίληψη Προφίλ Ασφάλειας Trimbow® 87/5/9
3. Περίληψη Προφίλ Ασφάλειας Trimbow® 172/5/9






Διαμοιρασμός περιεχομένου