Σχεδιασμός Μελέτης
Η μελέτη IMPROVE είναι μια προοπτική, πολυκεντρική, μη-παρεμβατική μελέτη παρατήρησης διάρκειας 52 εβδομάδων που πραγματοποιήθηκε σε 1,103 συμπτωματικούς ασθενείς με μέτρια/σοβαρή ΧΑΠ. Όλοι οι ασθενείς είχαν ιστορικό τουλάχιστον μίας παρόξυνσης το προηγούμενο έτος και ελάμβαναν προηγουμένως θεραπεία με LABA/LAMA.1
Πρωτεύον Καταληκτικό Σημείο:
- Αλλαγή στις μέτριες/σοβαρές παροξύνσεις μετά από 52 εβδομάδες θεραπείας με τον μικροσωματιδιακό τριπλό συνδυασμό Trimbow® 87/5/9.
Δευτερεύοντα Καταληκτικά Σημεία:
- Αλλαγή στην κατάσταση υγείας (CAT).
- Αλλαγή στην πνευμονική λειτουργία.
- Αλλαγή στη συμμόρφωση στη θεραπεία (TAI).
Αποτελέσματα Μελέτης

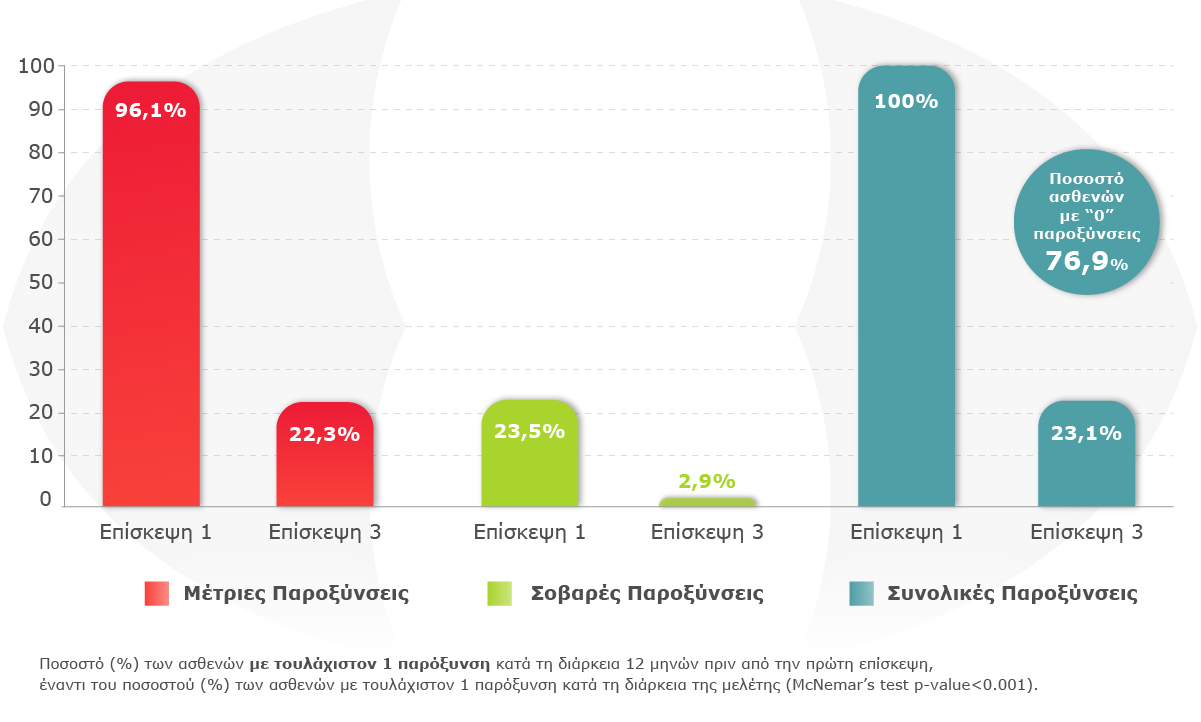
Μείωση Παροξύνσεων:
Η κλιμάκωση από LABA/LAMA στον μικροσωματιδιακό σταθερό τριπλό συνδυασμό Trimbow® 87/5/9 οδήγησε σε σημαντική μείωση των παροξύνσεων στους ασθενείς με ΧΑΠ. Το ποσοστό των ασθενών με τουλάχιστον 1 παρόξυνση κατά τη διάρκεια της μελέτης ήταν σημαντικά χαμηλότερο σε σύγκριση με το ποσοστό πριν από την πρώτη επίσκεψη.
Βελτίωση στην Ποιότητα Ζωής:
Η θεραπεία με Trimbow® 87/5/9 είχε θετική επίδραση στην ποιότητα ζωής των ασθενών, με το CAT σκορ να βελτιώνεται σημαντικά κατά τη διάρκεια της μελέτης.
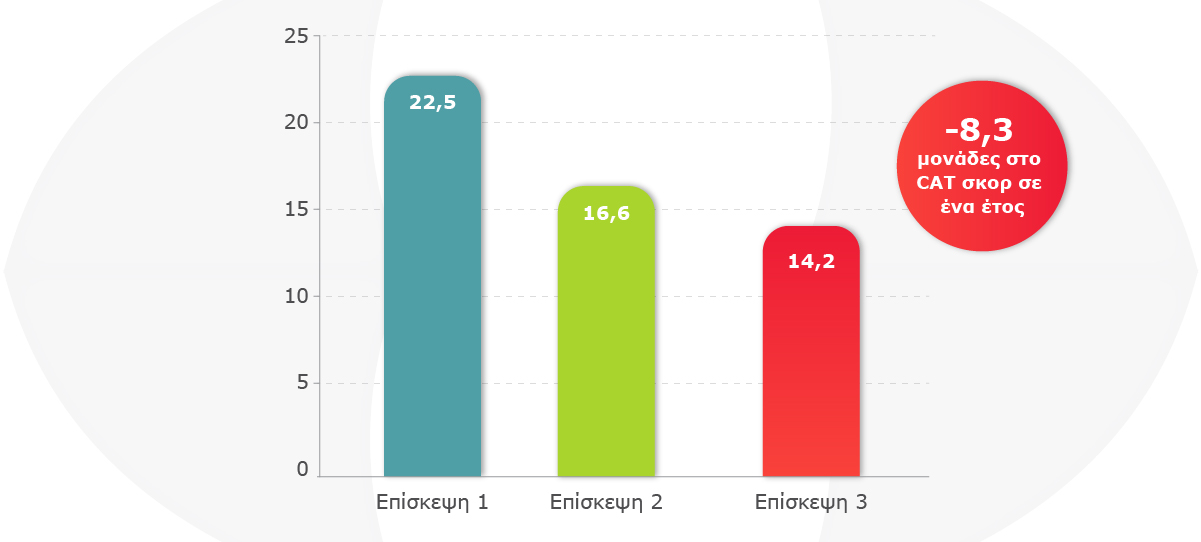
- Κλίμακα: 0 (καλύτερη δυνατή κατάσταση υγείας) έως 40 (χειρότερη δυνατή κατάσταση υγείας).
- P-value <0.001 για όλα τα ζεύγη συγκρίσεων.
- MCID για CAT σκορ: μείωση κατά 2 μονάδες.
Συμπέρασμα
.jpg)
Περίληψη Προφίλ Ασφάλειας Trimbow® 87/5/9:
Οι πιο συχνά αναφερθείσες ανεπιθύμητες ενέργειες σε ασθενείς με ΧΑΠ ή άσθμα είναι αντίστοιχα: δυσφωνία (0,3% και 1,5%) και στοματική καντιντίαση (0,8% και 0,3%), οι οποίες συσχετίζονται κατά κανόνα με τα εισπνεόμενα κορτικοστεροειδή, μυϊκοί σπασμοί (0,4% και 0,2%), οι οποίοι μπορούν να αποδοθούν στο συστατικό β2 διεγέρτη μακράς δράσης και ξηροστομία (0,4% και 0,5%), η οποία αποτελεί τυπική αντιχολινεργική δράση. Σε ασθματικούς ασθενείς, οι ανεπιθύμητες ενέργειες τείνουν να συγκεντρώνονται κατά τη διάρκεια των πρώτων 3 μηνών μετά την έναρξη της θεραπείας και γίνονται λιγότερο συχνές με τη μακροχρόνια χρήση (μετά από 6 μήνες θεραπείας). Το Trimbow® αντενδείκνυται σε ιστορικό υπερευαισθησίας στις δραστικές ουσίες ή σε κάποιο από τα έκδοχά του. Για περισσότερες πληροφορίες για τις ανεπιθύμητες ενέργειες του Trimbow® συμβουλευτείτε την Περίληψη Χαρακτηριστικών Προϊόντος του Φαρμάκου.2
Σε μια μελέτη 4 εβδομάδων, το προφίλ ασφάλειας της κόνεως για εισπνοή Trimbow ήταν παρόμοιο με εκείνο που παρατηρήθηκε για το διάλυμα υπό πίεση Trimbow®. Οι πιο συχνά αναφερθείσες ανεπιθύμητες ενέργειες σε ασθενείς με ΧΑΠ ή άσθμα με το διάλυμα υπό πίεση Trimbow® είναι αντίστοιχα δυσφωνία (0,3% και 1,5%) και στοματική καντιντίαση (0,8% και 0,3), οι οποίες συσχετίζονται κατά κανόνα με τα εισπνεόμενα κορτικοστεροειδή, μυϊκοί σπασμοί (0,4% και 0,2%), οι οποίοι μπορούν να αποδοθούν στο συστατικό β2-διεγέρτη μακράς δράσης, και ξηροστομία (0,4% και 0,5%), η οποία αποτελεί τυπική αντιχολινεργική δράση. Ομοίως, ξηροστομία αναφέρθηκε σε 2 ασθενείς (0,6%) με την κόνι για εισπνοή Trimbow®. Το Trimbow® σε συσκευή εισπνοής NEXThaler® αντενδείκνυται σε ιστορικό υπερευαισθησίας στις δραστικές ουσίες ή σε κάποιο από τα έκδοχά του. Για περισσότερες πληροφορίες για τις ανεπιθύμητες ενέργειες του Trimbow® σε συσκευή εισπνοής NEXThaler® συμβουλευτείτε την Περίληψη Χαρακτηριστικών Προϊόντος του Φαρμάκου.3
Βιβλιογραφία
- Kosmas E. et al., Abstract in 33rd Panhellenic Pulmonology Congress - AA190, available from: https://www.33pneumonologiko2024.gr/ergasies/vivlio-perilhpseon/. This study was funded by Chiesi Hellas S.A
- Trimbow 87/5/9 ΠΧΠ
- Trimbow 88/5/9 ΠΧΠ






Διαμοιρασμός περιεχομένου