Τα συμπτώματα της ΧΑΠ μπορεί να διαφέρουν σε συχνότητα, βαρύτητα και τύπο καθ' όλο το 24ωρο, συχνά ανάλογα με την ηλικία του ασθενούς και τη βαρύτητα της νόσου, με τα πρωινά και νυκτερινά συμπτώματα να αναφέρονται ως ιδιαίτερα επιβαρυντικά.1,2
Ο επιπολασμός των νυκτερινών συμπτωμάτων και της συμπτωματικής διαταραχής του ύπνου μπορεί να υπερβαίνει το 75% σε ασθενείς με ΧΑΠ.3
Όσον αφορά στην επίτευξη των θεραπευτικών στόχων για τους ασθενείς με ΧΑΠ, η εξασφάλιση και διατήρηση ποιοτικού ύπνου μέσω της αντιμετώπισης των νυκτερινών συμπτωμάτων είναι πολύ σημαντική.1-5
Σχεδιασμός Μελέτης
Η μελέτη TriTrial6 είναι μια πολυκεντρική, προοπτική μελέτη παρατήρησης με το μικροσωματιδιακό σταθερό τριπλό συνδυασμό Trimbow® 87/5/9 που διεξήχθη στην Ιταλία, σε 656 ασθενείς με μέτρια ή σοβαρή ΧΑΠ, διάρκειας 52 εβδομάδων.
Οι ασθενείς που εντάχθηκαν στη μελέτη ήταν ηλικίας άνω των 40 ετών, χωρίς έλεγχο της νόσου (CAT ≥10), με ιστορικό μίας τουλάχιστον μέτριας/σοβαρής παρόξυνσης το προηγούμενο έτος.
Η έναρξη της θεραπείας με Trimbow® 87/5/9 αποφασίστηκε από τον θεράποντα ιατρό σύμφωνα με την Π.Χ.Π. του προϊόντος και εντός 14 ημερών πριν από την ένταξη στη μελέτη.
Ως προηγούμενη θεραπεία οι ασθενείς ελάμβαναν LABA/LAMA (29%), ICS/LABA (30%), ICS/LABA/LAMA (34%) σε κλειστούς ή ανοιχτούς συνδυασμούς.
Πρωτεύον καταληκτικό σημείο:
H αλλαγή στο CAT σκορ στις 52 εβδομάδες σε σύγκριση με την έναρξη της θεραπείας.
Δευτερεύοντα καταληκτικά σημεία:
Συμμόρφωση και ικανοποίηση με το Trimbow 87/5/9, επίδραση στην HRQoL^, ποιότητα του ύπνου, παράμετροι πνευμονικής λειτουργίας, εμφάνιση παροξύνσεων.
^HRQoL: Σχετιζόμενη με την υγεία ποιότητα ζωής
Αποτελέσματα Μελέτης
Το 89% των ασθενών που συμμετείχαν στη μελέτη εμφάνισαν τουλάχιστον μία μέτρια παρόξυνση το προηγούμενο έτος, ενώ το 27% εμφάνισε τουλάχιστον μία σοβαρή παρόξυνση. Ο μέσος αριθμός των παροξύνσεων το προηγούμενο έτος ανά ασθενή ήταν 1,9 για τις συνολικές παροξύνσεις και 1,1 για τις σοβαρές παροξύνσεις.
Το 77% των ασθενών που συμμετείχαν στη μελέτη έπασχαν από τουλάχιστον μία συνοδό πάθηση με τις συχνότερες να είναι αγγειακές (42,6%), καρδιολογικές (25,3%) και μεταβολικές (22,7%).
Οι λόγοι που οδήγησαν τους ιατρούς σε αλλαγή της υπάρχουσας θεραπείας σε Trimbow® 87/5/9 ήταν:

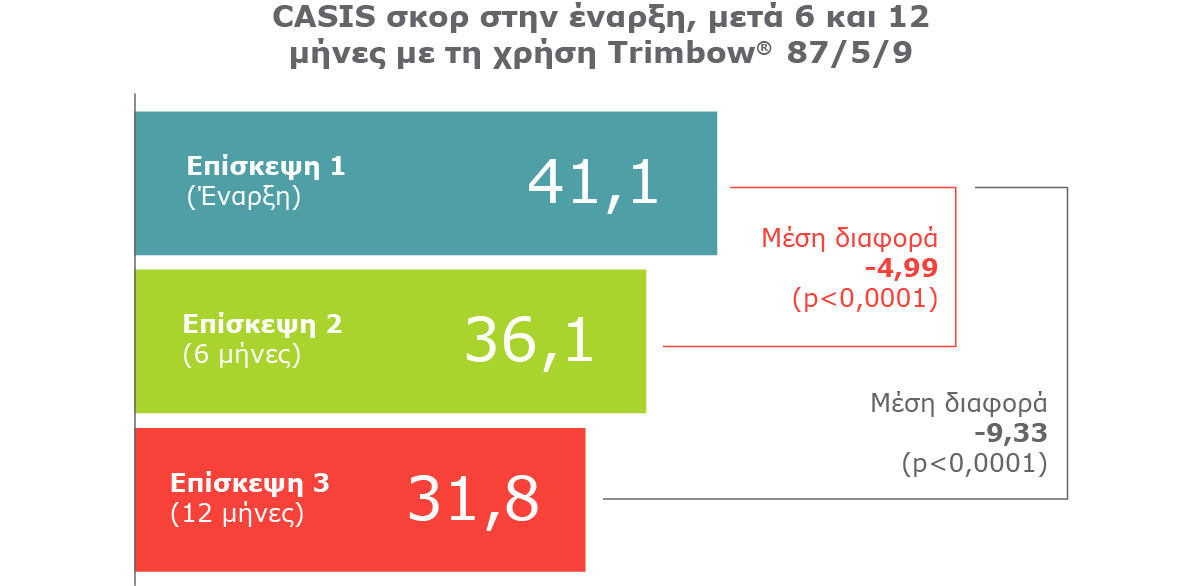
Βελτίωση στην Ποιότητα Ζωής6:
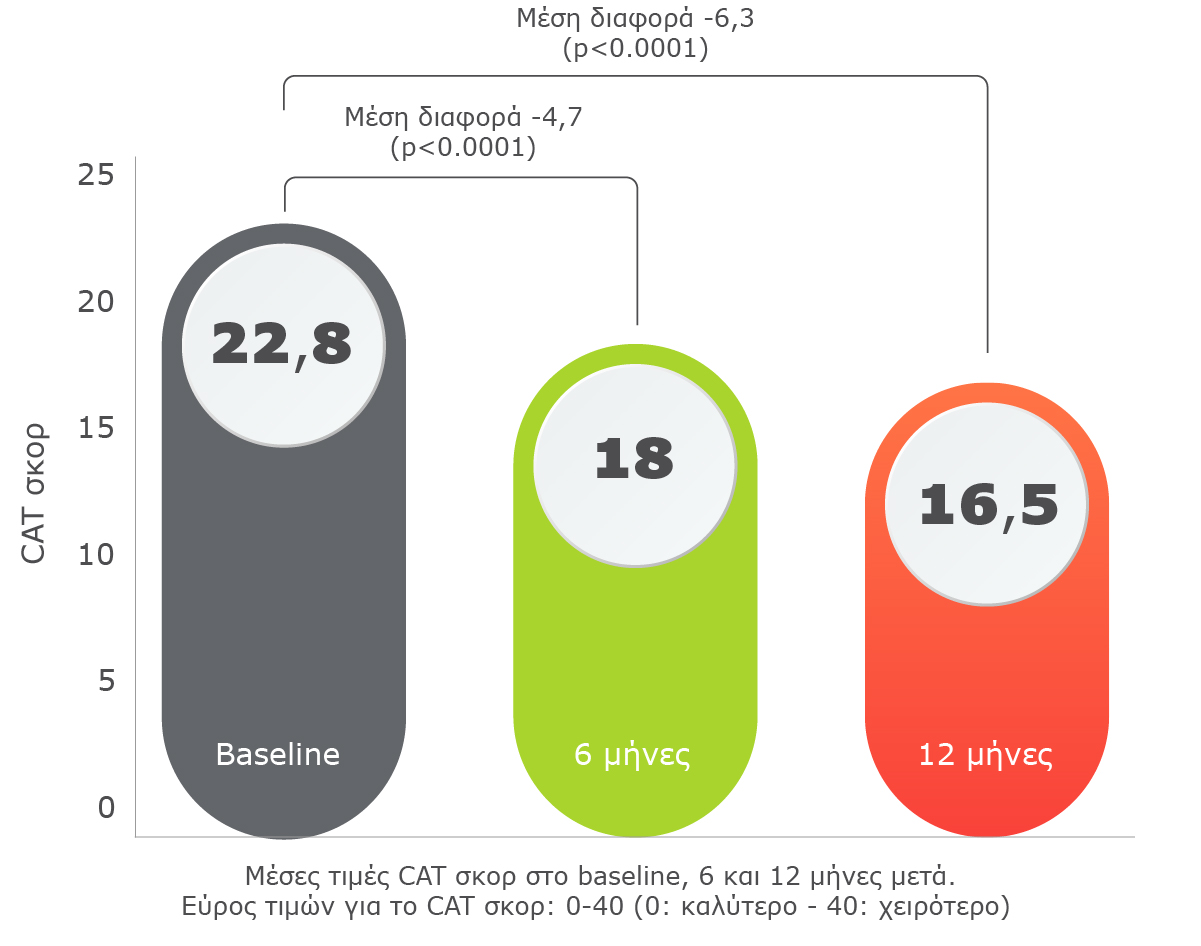
Η θεραπεία με Trimbow® 87/5/9 είχε θετική επίδραση στην ποιότητα ζωής των ασθενών, με το CAT σκορ να βελτιώνεται σημαντικά κατά τη διάρκεια της μελέτης.
Η μέση τιμή του CAT σκορ μειώθηκε κατά 6.3 μονάδες 12 μήνες μετά την έναρξη χρήσης Trimbow® 87/5/9 (p<0.0001).
Ποιότητα του ύπνου6:
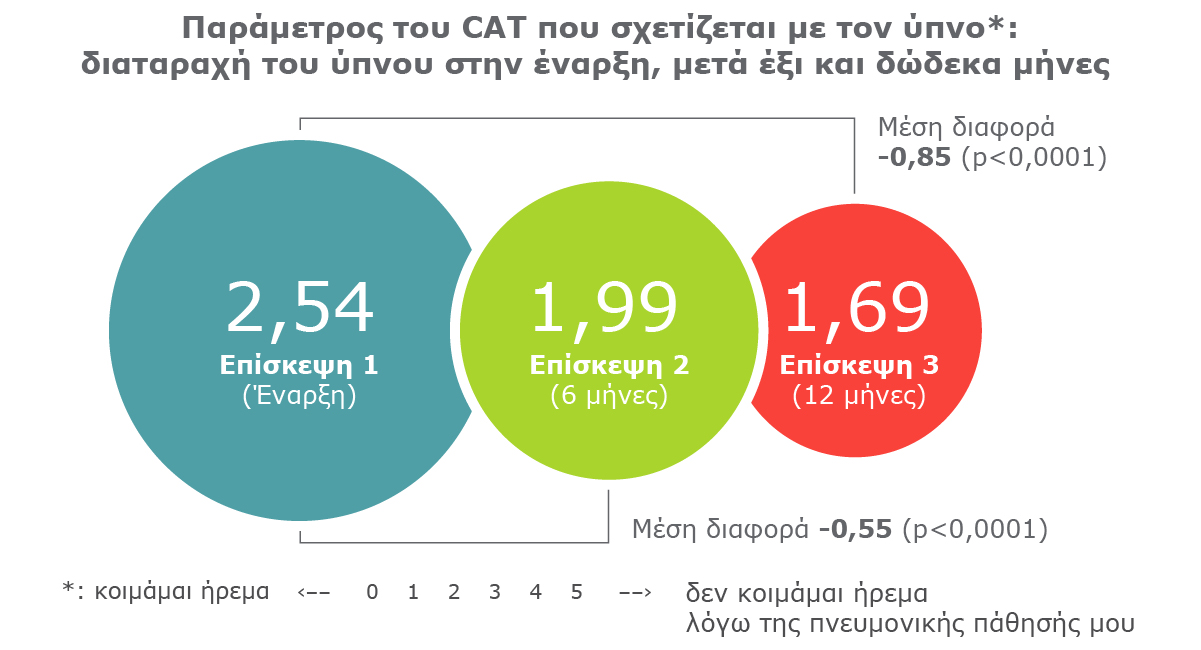
Ο μικροσωματιδιακός συνδυασμός Trimbow® 87/5/9 βελτιώνει την ποιότητα ύπνου των ασθενών με ΧΑΠ.
Η μέση διαφορά της παραμέτρου του CAT που σχετίζεται με τον ύπνο μειώθηκε κατά 0,85 μονάδες 12 μήνες μετά την έναρξη χρήσης Trimbow® 87/5/9 (p<0.0001).
Συμπέρασμα

Περίληψη Προφίλ Ασφάλειας Trimbow® 87/5/9:
Οι πιο συχνά αναφερθείσες ανεπιθύμητες ενέργειες σε ασθενείς με ΧΑΠ ή άσθμα είναι αντίστοιχα: δυσφωνία (0,3% και 1,5%) και στοματική καντιντίαση (0,8% και 0,3%), οι οποίες συσχετίζονται κατά κανόνα με τα εισπνεόμενα κορτικοστεροειδή, μυϊκοί σπασμοί (0,4% και 0,2%), οι οποίοι μπορούν να αποδοθούν στο συστατικό β2 διεγέρτη μακράς δράσης και ξηροστομία (0,4% και 0,5%), η οποία αποτελεί τυπική αντιχολινεργική δράση. Σε ασθματικούς ασθενείς, οι ανεπιθύμητες ενέργειες τείνουν να συγκεντρώνονται κατά τη διάρκεια των πρώτων 3 μηνών μετά την έναρξη της θεραπείας και γίνονται λιγότερο συχνές με τη μακροχρόνια χρήση (μετά από 6 μήνες θεραπείας). Το Trimbow® αντενδείκνυται σε ιστορικό υπερευαισθησίας στις δραστικές ουσίες ή σε κάποιο από τα έκδοχά του. Για περισσότερες πληροφορίες για τις ανεπιθύμητες ενέργειες του Trimbow® συμβουλευτείτε την Περίληψη Χαρακτηριστικών Προϊόντος του Φαρμάκου.8
Σε μια μελέτη 4 εβδομάδων, το προφίλ ασφάλειας της κόνεως για εισπνοή Trimbow ήταν παρόμοιο με εκείνο που παρατηρήθηκε για το διάλυμα υπό πίεση Trimbow®. Οι πιο συχνά αναφερθείσες ανεπιθύμητες ενέργειες σε ασθενείς με ΧΑΠ ή άσθμα με το διάλυμα υπό πίεση Trimbow® είναι αντίστοιχα δυσφωνία (0,3% και 1,5%) και στοματική καντιντίαση (0,8% και 0,3), οι οποίες συσχετίζονται κατά κανόνα με τα εισπνεόμενα κορτικοστεροειδή, μυϊκοί σπασμοί (0,4% και 0,2%), οι οποίοι μπορούν να αποδοθούν στο συστατικό β2-διεγέρτη μακράς δράσης, και ξηροστομία (0,4% και 0,5%), η οποία αποτελεί τυπική αντιχολινεργική δράση. Ομοίως, ξηροστομία αναφέρθηκε σε 2 ασθενείς (0,6%) με την κόνι για εισπνοή Trimbow®. Το Trimbow® σε συσκευή εισπνοής NEXThaler® αντενδείκνυται σε ιστορικό υπερευαισθησίας στις δραστικές ουσίες ή σε κάποιο από τα έκδοχά του. Για περισσότερες πληροφορίες για τις ανεπιθύμητες ενέργειες του Trimbow® σε συσκευή εισπνοής NEXThaler® συμβουλευτείτε την Περίληψη Χαρακτηριστικών Προϊόντος του Φαρμάκου.9
Βιβλιογραφία
- Singh D. et al., Adv Ther. 2017;34(2):281-299
- Braghiroli A. et al., Int J Chron Obstruct Pulmon Dis. 2020 Jun 4;15:1269-1285
- Agusti A. et al., Eur Respir Rev. 2011;20(121):183-194
- Partridge MR. et al., Curr Med Res Opin. 2009;25(8):2043-2048
- Miravitlles M. et al., Respir Res. 2017;18(1):67
- Richeldi L. et al., Int J Chron Obstruct Dis. 2024 Feb 23; 19: 475-487
- Richeldi L. et al., Int J Chron Obstruct Pulmon Dis. 2021 Jan 27;16:159-166.
- Trimbow® 87/5/9 ΠΧΠ
- Trimbow® συσκευή εισπνοής NEXThaler® ΠΧΠ
CC-WEB-TR-2-01/2025






Διαμοιρασμός περιεχομένου